Nat Immunol:揭示常见代谢产物琥珀酸恶化人类炎性肠病背后的分子机制
来源:生物谷原创 2025-07-03 11:43
来自美国西北大学等机构的科学家们通过研究发现,琥珀酸能通过“琥珀酰化-泛素化”分子开关来调控FOXP3的降解,从而有望为人类炎性肠病的治疗提供全新靶点。
如今,人类炎性肠病(IBD)正以惊人的速度席卷全球,欧美国家的年发病率已达10-20/10万,而中国的发病率在过去十年间激增超5倍,这一疾病不仅会给患者带来持续的腹痛、腹泻和营养不良,更与结肠癌风险升高密切相关。在IBD患者的肠道中,一种名为琥珀酸的代谢物浓度会异常升高,可达健康人群的10-100倍。此前研究发现,琥珀酸能激活巨噬细胞的炎症通路,但其如何精准打击免疫系统的“维和部队”—调节性T细胞(Treg),一直是未解之谜。Treg细胞依赖转录因子FOXP3来维持免疫抑制功能,而IBD患者Treg中FOXP3表达会显著下降。
近日,一篇发表在国际杂志Nature Immunology上题为“Succinate drives gut inflammation by promoting FOXP3 degradation through a molecular switch”的研究报告中,来自美国西北大学等机构的科学家们通过研究发现,琥珀酸能通过“琥珀酰化-泛素化”分子开关来调控FOXP3的降解,从而有望为人类炎性肠病的治疗提供全新靶点。
文章中,研究人员从临床样本出发收集了125名IBD患者(克罗恩病90例,溃疡性结肠炎35例)和37名健康对照的外周血及结肠组织。他们发现,患者Treg细胞中琥珀酸合成酶(OGDHc)的关键亚基Dlst表达会下降50%,从而就会导致琥珀酰辅酶A合成减少,这一代谢缺陷如同打开了潘多拉魔盒——原本被琥珀酰化修饰保护的FOXP3蛋白,其赖氨酸残基会暴露出来,被E3泛素连接酶STUB1识别并标记K48泛素链,最终触发蛋白酶体降解。
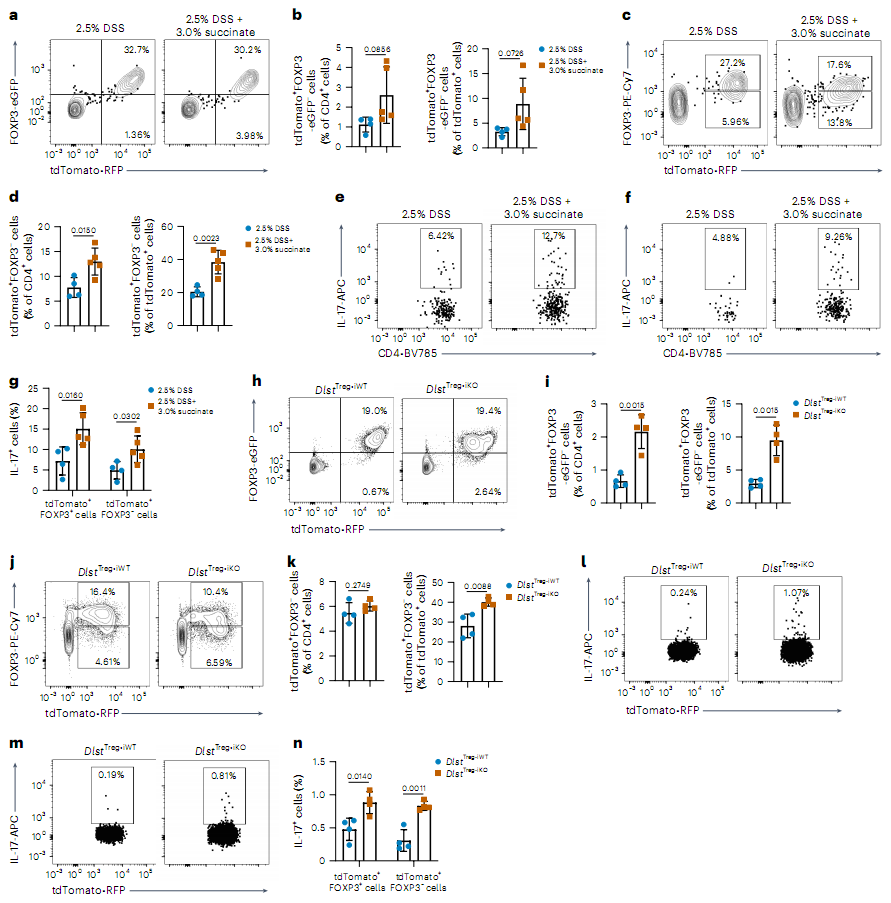
琥珀酸会促进Treg细胞中IL-17的产生,而不依赖于FOXP3
为了验证这一机制,研究人员构建了Dlst基因条件性敲除小鼠(DlstTreg-KO),并特异性破坏Treg细胞的OGDHc功能,随后这些小鼠迅速出现致死性结肠炎,其Treg细胞中的FOXP3蛋白不仅几乎消失,还会反常地分泌促炎因子IL-17并完全丧失免疫抑制能力;而当研究人员外源性补充琥珀酰辅酶A或突变FOXP3的赖氨酸位点(KDR)阻断泛素化时,Treg的功能竟奇迹般地恢复了。 临床数据进一步证实了这一发现,即IBD患者血浆琥珀酸水平与FOXP3表达呈显著负相关(r=-0.39, P<0.001),而在疾病缓解期,随着琥珀酸水平下降,Treg的功能就会逐渐恢复,这一发现将琥珀酸从单纯的炎症标志物升级为潜在的治疗靶点。
这项研究揭示了代谢物如何通过蛋白质翻译后修饰精密调控免疫细胞功能,为人类炎性肠病的治疗开辟了新思路。传统治疗聚焦于抑制炎症因子,而新发现提示我们:从源头阻断琥珀酸生成(如调节肠道菌群或抑制OGDHc活性),或保护FOXP3蛋白(如开发STUB1抑制剂)有望成为更精准的治疗策略。
未来研究人员还将进一步深入研究炎性肠病急性期琥珀酸升高的具体来源(如肠道上皮损伤或特定菌群失衡),以及琥珀酸是否通过表观遗传修饰(如组蛋白琥珀酰化)协同调控Treg命运?这些问题的答案将会推动代谢-免疫交叉领域的发展,也为炎性肠病患者的个体化治疗提供关键线索。(生物谷Bioon.com)
参考文献:
Wang, H., Hu, D., Cheng, Y. et al. Succinate drives gut inflammation by promoting FOXP3 degradation through a molecular switch. Nat Immunol 26, 866–880 (2025). doi:10.1038/s41590-025-02166-y
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


